
泸州观察 郭慧琳
“目前患者的肿瘤已经缩小了至少70%。”4月2日,聊起临床研究,西南医科大学附属医院肿瘤科副主任医师李丹教授点开了一份影像图片,翻到“诊断意见”处后说着。随后,她又点开了这一患者的另外一次影像图片,是患者刚入组参与临床研究时的检查所见,从两份影像图片诊断意见处可以明显看到,记录的病灶大小数据已由大变小,疗效十分显著。
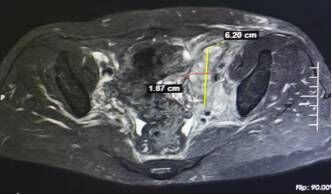
“尝新”入组Ⅲ期临床研究约7个月肿瘤减少至少70%
近日,李女士按医生要求,早早来到西南医科大学附属医院(康健中心院区)肿瘤科病区抽血室进行用药前检查,待检查结果出来医生评估合格后,便可以开始用药。
2019年3月,李女士被诊断出宫颈癌,由于发现早,李女士手术十分成功。“发现得早,处理得及时,术后恢复较好,便以为自己已经痊愈了。”李女士说,“因此对该疾病没有过于在意,也没有定期到医院随访。”
去年7月,李女士在一段时间内出现腰背疼痛的症状,伴左小腿肿大,且症状久久没有缓解,以为是其腰椎间盘突出引起的,便到医院进行检查。经CT检查后,结果让李女士很意外。结果显示其腹膜后、腹股沟淋巴结肿大,腰背部疼痛、小腿肿大一系列症状,均是因肿瘤压迫导致的。
“在病房见到李女士时,她精气神十足,如果不知道其病情,我很难将这位仅41岁患者,同癌症患者联系到一起。”李丹教授说。李丹教授将李女士所有病历资料翻阅研究后,结合诊疗指南,建议其进一步完善基因检测,再进行药物治疗。
李丹教授在制定治疗方案时,还为李女士准备了一份备选方案——关于复发转移性宫颈癌免疫联合化疗±抗血管生成药物的Ⅲ期临床研究。“临床研究并非人人都适用,需对患者病情进行评估,符合条件的患者才能入组临床研究。”李丹教授说。
面对多个治疗方案,李女士一开始是矛盾的,搜索相关资料、向朋友咨询……经过两天反复地思考和商讨,李女士最后决定选择“尝新”,入组Ⅲ期临床研究方案。“久病成医,对用药有简单的认识,经过各种渠道咨询,得到都是正面回复。且这个临床研究方案和李医生介绍的‘一线’选择方案基本一致,我想尝试一下。”李女士说。
任意一项筛查结果不符合标准即筛选失败临床研究用药“随机双盲”
患者入组该临床研究方案,用药前不仅要患者签署《知情同意书》,针对组织病理标本超过最佳基因检测期的患者,还需要重新进行组织病理标本活检。也就是说,患者需再次通过组织病理标本活检确认病理类型;经基因检测后,基因表达呈阳性,才符合入组条件。
“临床研究的流程是非常严格的,一项结果不符合入组标准,就意味着筛选失败。所有筛查结果均符合入组条件,即可以随机入组。”李丹教授说。
李女士经过两次活检后,顺利获取组织标本,基因检测符合入组条件。之所以称之为“随机”,是因为李女士的用药是随机双盲的。也就是说,李女士和李丹教授均不知道其使用的免疫治疗药物,是安慰剂,还是实验用药。
去年8月,李女士开始用药,截至目前已入组治疗约7个月。据李女士介绍,一开始进行了6次化疗治疗,从用药开始到现在,整个治疗过程,她没有感到任何不适,精神和胃口都很好。
Ⅲ期临床研究所用的治疗方案实际是在标准治疗方案的基础上,进行了改善和优化。“‘随机’用药并不会增加心理负担,非实验组用药方案仍可以发挥疗效。临床研究会进行定期疗效评估,让患者和医生更了解治疗效果。”李女士说。
今年1月,李女士再次到医院进行复查,其检查结果显示,肿瘤已经缩小至少70%。得知这一消息时,李女士悬着的心落下了不少。目前,李女士已完成了6个周期的联合治疗,正在进行免疫药物维持治疗中。

患者近期疗效评估病灶大小(部分层面代表)
新药上市或挤入“一线”的必经之路入组治疗不是充当“小白鼠”
临床研究方案和标准方案有何不同?李丹教授表示,该Ⅲ期临床研究方案实际是验证一个已上市的免疫治疗药物,是否可以联合化疗±靶向药物用于复发转移性宫颈癌患者一线治疗。目前指南推荐使用的免疫治疗药物为进口药,疗效显著,但费用较高。但市面上已经有国产同类免疫治疗药物,但要证明该药在用于复发转移性宫颈癌患者‘一线’治疗,其疗效与进口相同或优于进口药,就必须经过患者实际临床使用验证疗效才能获批适应症。
往往临床针对复发转移性癌症患者或者难治性疾病患者制定治疗方案时,除了告知诊疗指南首选治疗方案外,均会告知可能符合的相应的临床研究方案作为备选治疗方案之一。
新药临床研究是把患者的利益摆在第一位,均要经过国家备案、获得批号才能在临床使用。新药临床研究是受法律法规管控的,接受临床研究方案的患者是受法律法规保护的。李丹教授说:“在临床研究中,所有与之相关的不良反应均要及时记录,严重的不良反应需在24小时上报给申办方、临床研究管理机构以及伦理机构。所有的临床研究用药,相关检查检验以及与药物相关不良反应处理费用均由申办方报销。”
由此可见,和常规治疗相比,入组临床研究的患者能得到更精细的管理,临床研究的每个环节均是被监控的,并随时准备接受相关机构的抽查。用李丹教授的话来说,临床研究是新药上市或“论资排辈”前,必须经历的“华山论剑”。是在以患者为核心,保障患者医疗质量的前提下,解决临床诊疗困局,突破传统疗效,争取研发更高效低毒药物的必经流程。同时,接受临床研究均是自愿的,试验过程中受试者具有充分的知情权和决定权,可以选择在试验的任何阶段随时退出而不会受到任何影响。(受访者供图)